英国 (UK) 于 2020 年 1 月 31 日正式退出欧盟 (EU)。过渡期始于 2020 年 2 月 1 日,止于 2020 年 12 月 31 日。自 2021 年 1 月 1 日起,英国被视为欧盟的第三国。此页面概述了英国脱欧对使用 RIM Vault 的客户的影响,包括客户为了继续在英国或欧盟许可产品或许可新产品而可以在 Vault 中采取的一些操作。
注意:尽管《退出协议》已经最终确定,MHRA 依然会继续更新其指导。请联系 EMA 和 MHRA,以了解最新信息。
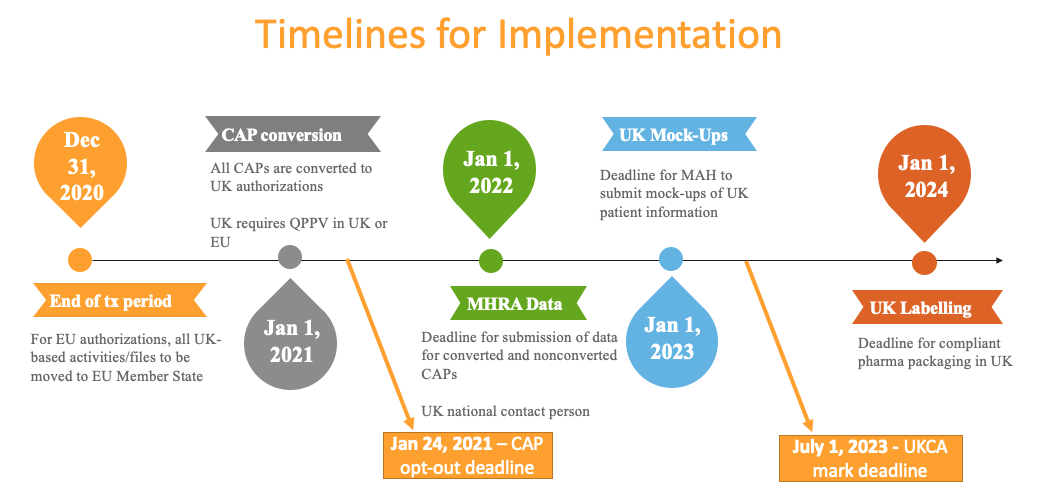
时间表
根据产品是药品还是设备以及是否将产品转换为 GB MA(市场营销授权),需要遵守不同的时间表。此时间表提供了所需截止日期的概述:
对药品的影响
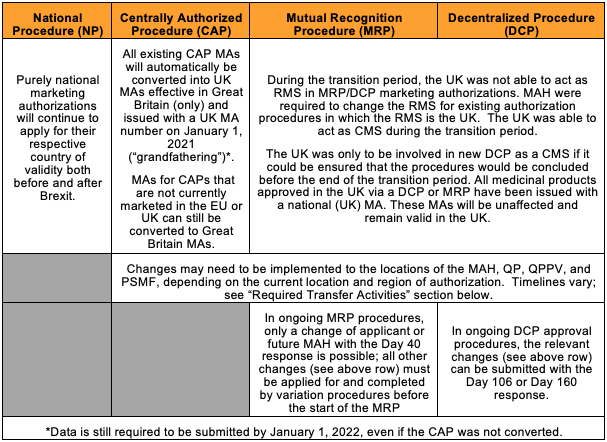
英国脱欧所产生的影响不尽相同,具体情况取决于对药品应用的程序类型。现有的集中授权程序 (CAP) 产品已于 2021 年 1 月 1 日自动转换为 GB MA。通过一个非集中程序 (DCP) 和双向认证程序 (MRP) 授权的产品已使用 GB 国家 MA 发布,而且不会受到影响。
对于由集中程序授权的产品,MHRA 要求在 2022 年 1 月 1 日之前提交一个基线送审,并将根据英国目前用于确定产品系列所需单独国家许可证数量的惯例,发布一个或多个产品许可证编号。与 EC 授权相比,所需的 GB MA 编号通常更少,因为单个 MA 编号将涵盖所有用于演示的包装尺寸。市场营销授权持有人 (MAH) 可以在 2021 年 1 月 21 日的营业时间结束之前书面通知 MHRA,以选择退出他们的全部或部分 CAP 的转换过程。对于北爱尔兰,如果 CAP 未传承至 GB 许可证,则 MHRA 依然要求在 2022 年 1 月 1 日之前提交一个基线送审。
此表简要概括了对现有欧盟市场授权的影响以及 MAH 需要采取的措施:
所需的转让活动
为了继续营销产品以及确保经过授权的产品可继续留在欧盟或英国的市场,MAH 需要在不同的时间点采取某些措施。此表概述了需要在欧盟或英国开展的行动:
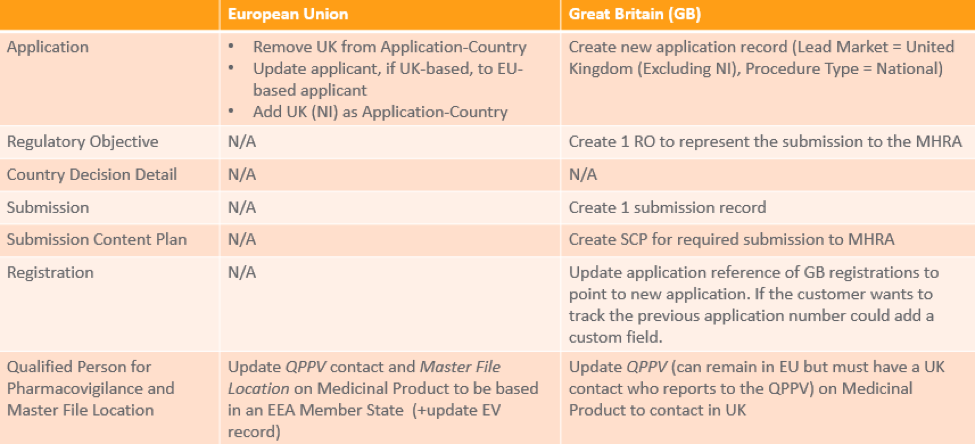
Vault 中的现有 CAP 授权
此表提供了有关如何在 Vault 中根据产品面向的营销市场管理现有 CAP 的信息。
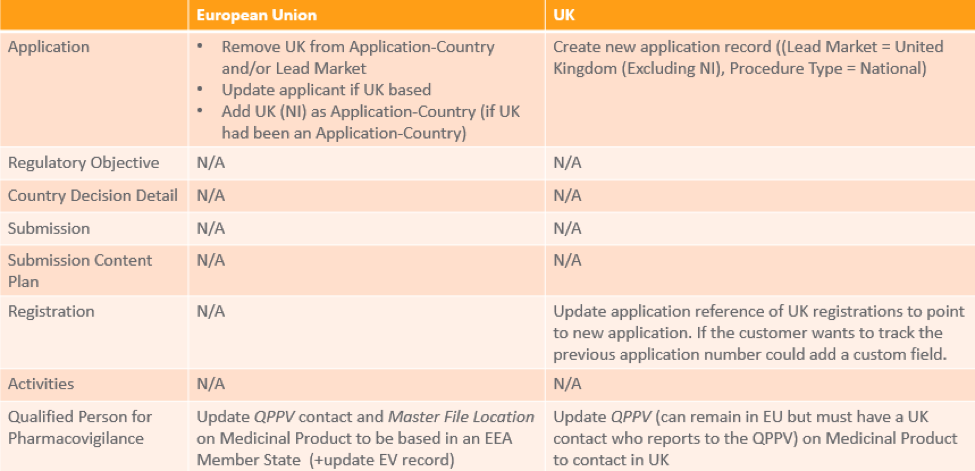
Vault 中的现有 MRP 和 DCP 授权
此表提供了有关如何在 Vault 中根据产品面向的营销市场管理现有 MRP 或 DCP 授权的信息。
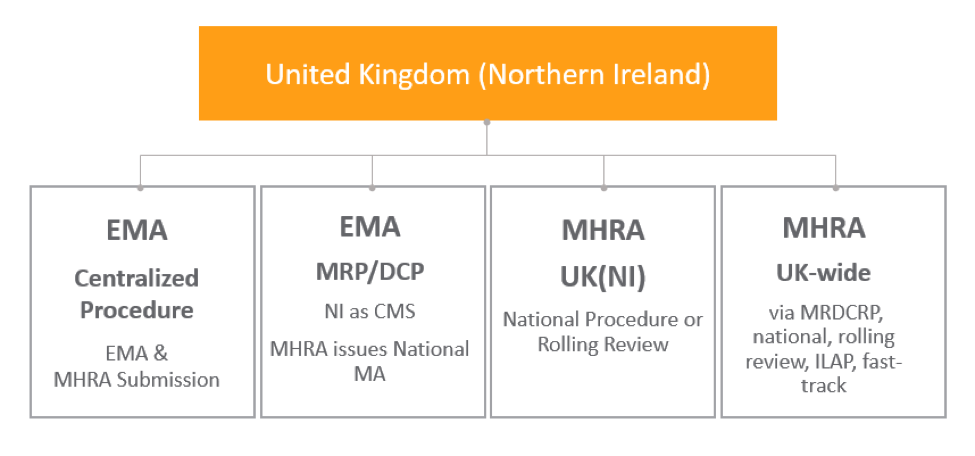
北爱尔兰
达成北爱尔兰协议是为了缓和北爱尔兰与身为欧盟国家的爱尔兰之间的边界冲突。此协议可确保并非欧盟国家的北爱尔兰遵守欧盟法规,并获得与爱尔兰共和国同等的市场准入条件。
对于现有的 CAP,如果产品在大不列颠营销,但不在北爱尔兰营销,MAH 应向 EMA 发送一个最新市场营销状态报告,以提醒他们已在北爱尔兰停止营销这一情况。如果在北爱尔兰营销 CAP,则无需对营销状态进行任何更改。新的 CAP 会继续在北爱尔兰有效,尽管还需要向 MHRA 提交送审。
此表显示了组织如何通过 MHRA 或 EMA 程序取得北爱尔兰授权:
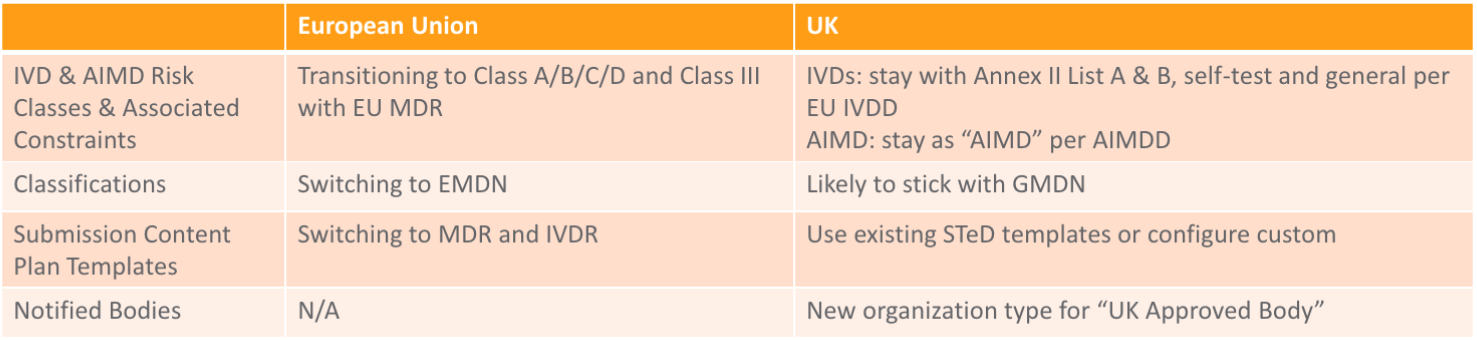
对医疗设备的影响
设备制造商应将自己的 CE 证书转给一家欧盟公告机构,并获得欧盟的一个授权代表,以确保在 2020 年 12 月 31 日之后继续营销。
Vault 中的医疗设备
此表提供了有关如何在 Vault 中根据产品面向的营销市场管理设备申请的信息。
CE 标志和注册
MHRA 在 2023 年 6 月 30 日之前认可拥有 CE 标志(包括 AIMDD/MDD/IVDD 和 MDR/IVDR 等欧盟 CE 证书)的设备。新的 UKCA 标志将于 2021 年 1 月 1 日启用,自 2023 年 7 月 1 日起,英国的设备必须拥有此标志。自 2021 年 1 月 1 日起,向英国市场投放的所有医疗设备和 IVD 都需要向 MHRA 注册,但可以享有一个宽限期。
UKNI 标志
向北爱尔兰市场投放的设备依然需要拥有 CE 标志,并且应当符合欧盟规则。自 2021 年 1 月 1 日起,在北爱尔兰营销设备时,可以使用两个选项:
- CE 标志和欧盟公告机构
- CE 标志和英国公告机构 + UKNI 标志
有关可接受的符合性标志和所需注册的更多信息,请参阅来自 MHRA 的最新指导。
英国负责人
外国制造商需要指定一名英国负责人,负责向 MHRA 注册设备。在 2021 年 1 月 1 日之前,必须指定英国负责人,无论向 MHRA 注册设备时是否享有宽限期。
针对英国脱欧事宜的 21R1 RIM 更改和配置更新
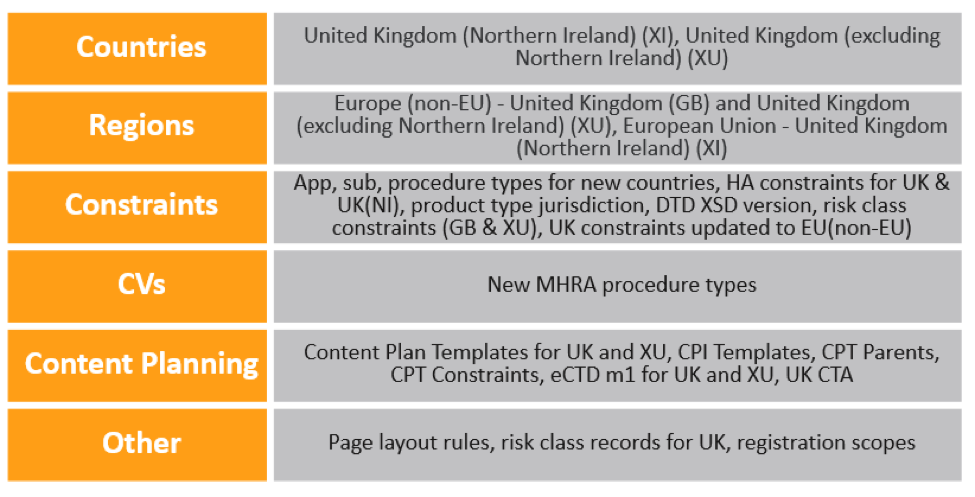
21R1 版之后新推出的任何 RIM 实施中自动包含以下更新,以应对英国脱欧事宜:
在现有的 Vault 中,管理员必须针对英国脱欧而引起的变化,进行以下配置更新:
- 在英国的国家/地区记录上,将地区更新为欧洲(非欧盟)。
- 更新名为欧盟的地区记录,以添加以下国家/地区:
国家/地区名称 | 地区 | 国家/地区代码 |
英国(北爱尔兰) | 欧盟 | XI |
英国(不包括北爱尔兰) | 欧洲(非欧盟) | XU |
- 添加约束记录,以包含新创建的国家/地区的相关申请类型、送审类型、送审子类型和卫生局。
- 为 UK、XI 和 XU 国家/地区代码更新或添加类型为产品类型管辖区的约束记录。
- 为英国的特定程序类型添加类型为 DTD XSD 版本的约束记录以及约束。
- 复制现有送审内容计划中的欧盟模块 1,以便为 GB 和 XU 国家/地区代码添加模块 1。此建议可能发生变化,具体情况取决于将来的 MHRA 指导。
请注意,创建注册向导将在未来的版本中更新为包含英国(北爱尔兰)。在此之前,用户可以在向导中手动添加此值。对于医疗设备,将来的版本还将包含一个新的组织类型——英国批准的机构。
针对英国脱欧事宜的 21R3 RIM 更改
在 21R3 (21R2.3) 中,对于程序类型为集中程序的申请,RIM Registrations Vault 中的批量注册创建向导自动包含英国(北爱尔兰)(国家/地区代码 = XI)。在 21R3 之前,常规版本的 Vault 的用户可以在向导中手动添加此值。