英国が 2020 年 1 月 31 日に欧州連合 (EU) から正式に離脱しました。移行期間は 2020 年 2 月 1 日に開始しで、2020 年 12 月 31 日に終了しました。2021 年 1 月 1 日時点で、英国は EU にとって第三国となります。このページでは、RIM Vault のお客様に対する英国の EU 離脱の影響を概説します。これには、英国または EU におけるライセンシングの継続、または新製品のライセンシングのために Vault に講じることができる措置が含まれます。
Note: 離脱協定は最終決定されましたが、MHRA は引き続きガイダンスを更新しています。最新の情報は EMA および MHRA をご確認ください。
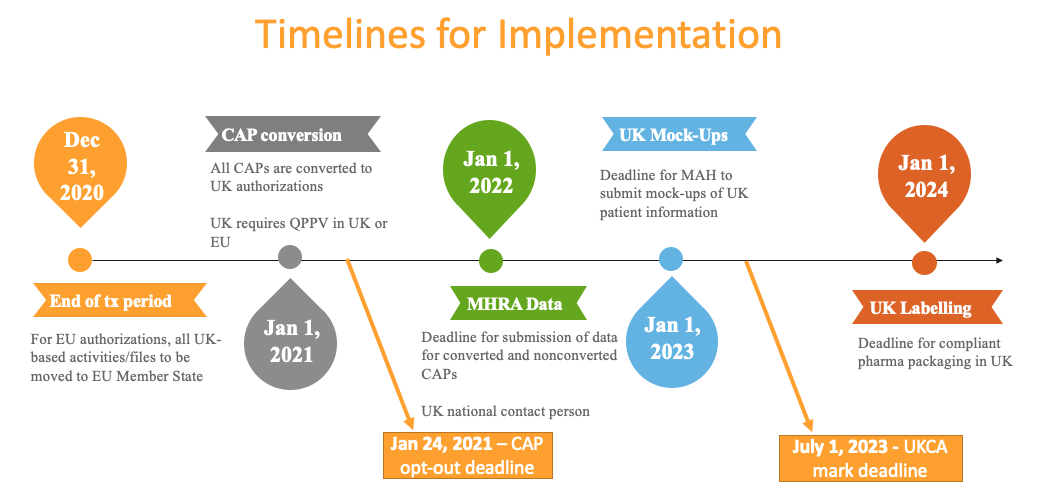
タイムライン
製品が医薬品か医療機器かによって、また、製品が英国の MA (販売承認) に変換されるか否かによって適用されるタイムラインが異なります。このタイムラインには必須期限の概要を示します:
医薬品への影響
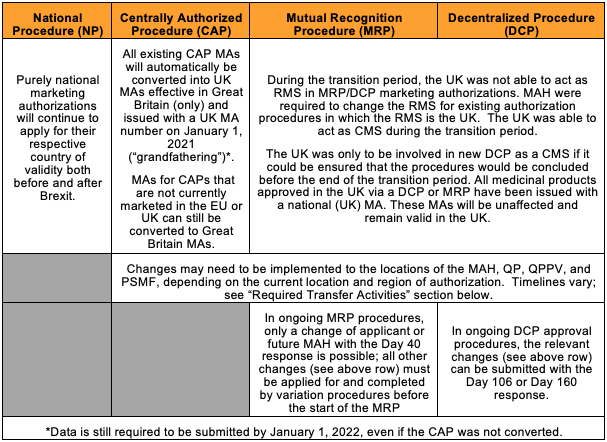
英国の EU 離脱の影響は、医薬品に適用される手続きの種類によって異なります。既存の中央管理手続き (CAP) では、製品は 2021 年 1 月 1 日に英国のMA に自動変換されました。分散管理手続き (DCP) および相互承認手続き (MRP) 経由で認可された製品は、英国内の MA を受けており、影響は受けません。
中央管理手続きで認可された製品の場合、MHRA は、2022 年 1 月 1 日までにベースラインの提出を求め、取扱製品全体に必要な個別の国内ライセンス番号を決定する既存の英国での手続きに基づいて、1 つまたは複数の製品ライセンス番号を発行します。通常、必要な英国 MA 番号は、EC 認証よりも少なくなります。これは、提示用のすべてのパックサイズに一つの MA 番号が適用されるためです。販売認証ホルダー (MAH) は、2021 年 1 月 21 日の営業終了時刻までに MHRA に書面で通知することで、CAP のすべてまたは一部に対する変換処理のオプトアウトを選択することができました。CAP が英国のライセンスの適用を受けていない場合、MHRA は北アイルランドについて、2022 年 1 月 1 日以前のベースライン提出を依然として要求しています。
この表には、既存の EU 販売認証に対する影響のほか、MAH が講じる必要がある措置に関する詳細な概要を記載します:
必要な転送措置
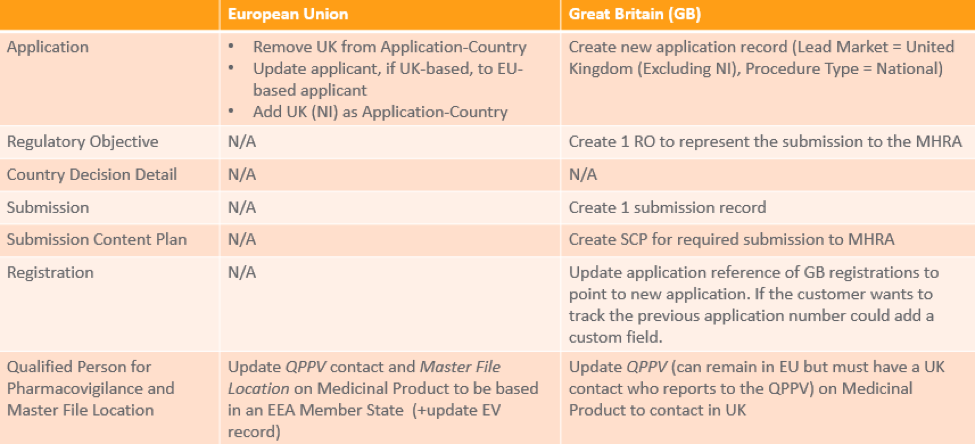
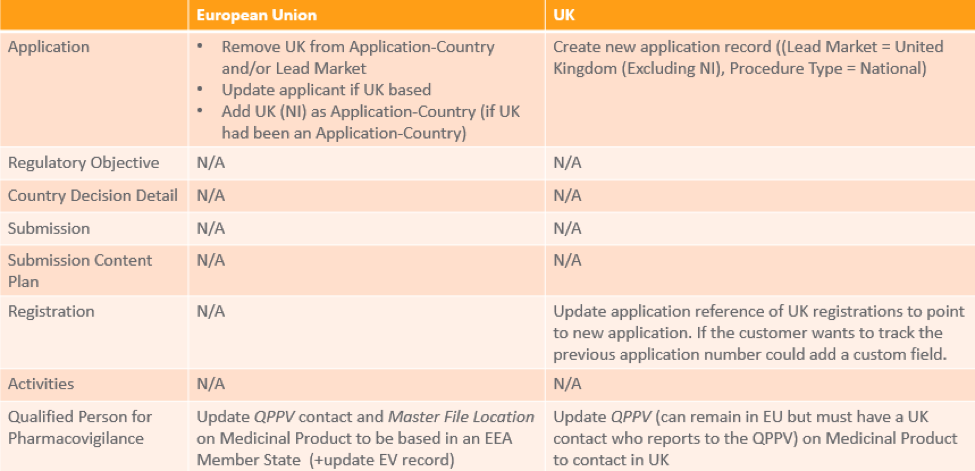
製品の販売を継続し、EU または英国での認可済み製品の販売維持を確実にするために、MAH は 様々な時点でしかるべき手段を講じる必要があります。この表には、EU または英国で必要な措置に関する概要を記載します:
Vault の既存の CAP 認証
この表には、製品の販売場所に応じた Vault の既存の CAP 認証管理に関する情報を記載します:
Vault の 既存の MRP および DCP 認証
この表には、製品の販売場所に応じた Vault の既存の MRP または DCP 認証の管理に関する情報を記載します:
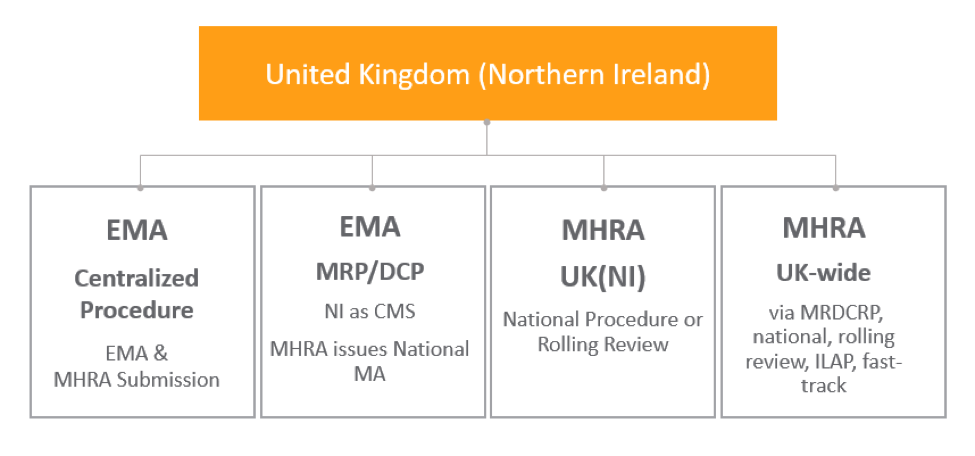
北アイルランド
北アイルランドのプロトコールは、北アイルランドと、EU 加盟国であるアイルランドとの厳密な国境を避けるために策定されました。このプロトコールは、EU の加盟国ではない北アイルランドが、EU の法律に従い、アイルランド共和国内で平等な市場アクセスを持つことができるようにするためのものです。
既存の CAP については、製品が英国で販売され、北アイルランドでは販売されていない場合、MAH は北アイルランドでの販売中止を警告するために更新されたマーケティングステータスレポートを EMA に送付する必要があります。CAP が北アイルランドで販売されている場合、マーケティングステータスの変更は必要ありません。MHRA へのサブミッションも必須ですが、新規の CAP は引き続き北アイルランドで有効です。
この表は、組織が MHRA または EMA の手続きによって北アイルランドの認可を取得する方法を示しています:
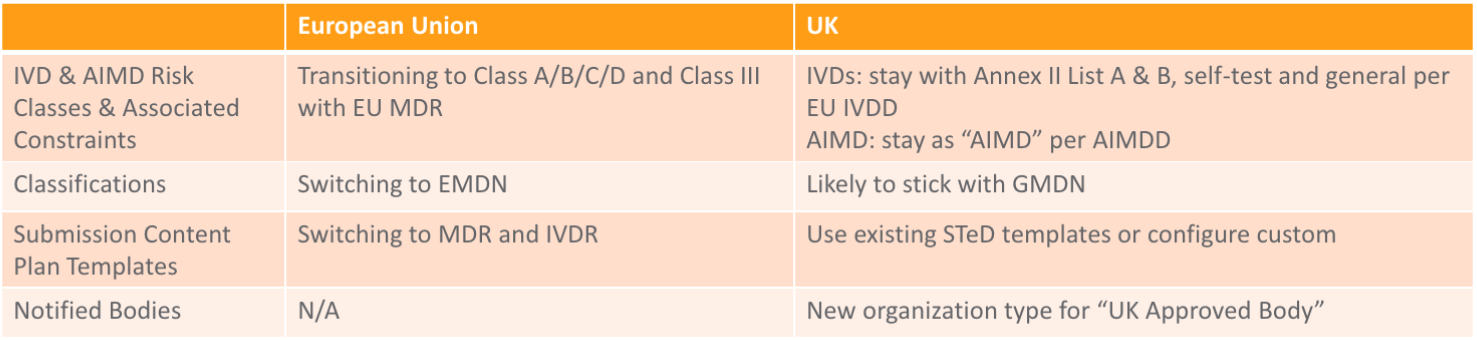
医療機器に対する影響
医療機器メーカーは、2020 年 12 月 31 日以降も販売継続できるように、CE 証明書を EU 通知機関に転送し、EU ベースの代理店としての認定を受けている必要があります。
Vault の医療機器
この表には、製品の販売場所に応じた Vault の機器の申請管理に関する情報を記載します:
CE マークおよび登録
MHRA は、EU ベースの CE 証明書 (AIMDD/MDD/IVDD および MDR/IVDR) を含み、2023 年 6 月 30 日まで CE マークを付した医療機器を許可します。新しい UKCA マークは、2021 年 1 月 1 日時点で使用可能となり、英国では 2023 年 7 月 1 日より医療機器に必須となります。2021 年 1 月 1 日以降、英国市場で販売されるすべての医療機器および IVD は、NHRA に登録される必要があります (猶予期間あり)。
UKNI 販売
北アイルランドで販売される医療機器には、引き続き CE マークが必要となり、EU の規則に準拠する必要があります。2021 年 1 月 1 日以降、北アイルランドで医療機器を販売するには 2 つの選択肢があります:
- EU 通知機関の CE マーク
- 英国通知機関の CE マークおよび UKNI マーク
条件を満たす適合マークおよび必要な登録に関する詳細は、MHRA の最新のガイドラインをご覧ください。
英国担当者
海外メーカーは、MHRA に医療機器を登録する責任者として英国担当者を任命する必要があります。英国担当者は、医療機器 MHRA に登録する猶予期間に関わらず、2021 年 1 月 1 日時点で任命されている必要があります。
21R1 英国の EU 離脱に伴う RIM の変更および設定更新
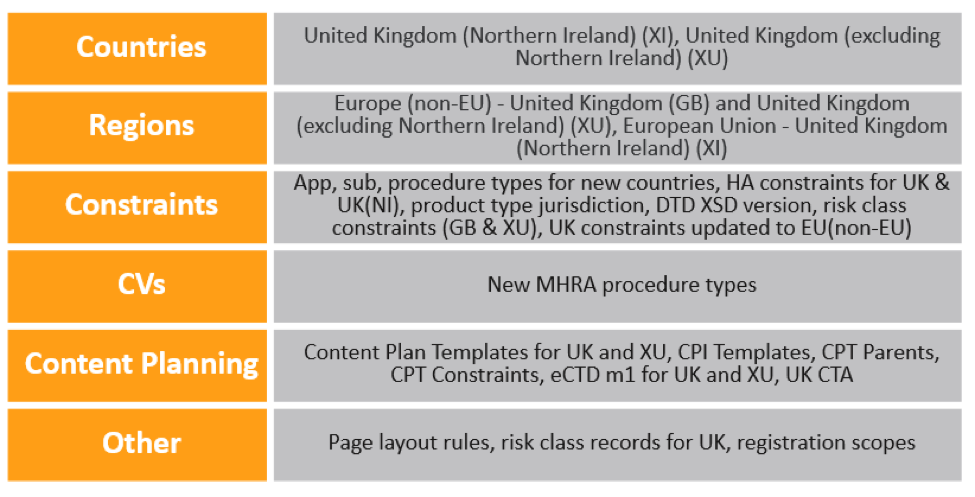
21R1 リリース以降に RIM を新規に実装する場合、英国の EU 離脱を考慮し、以下のアップデートが自動的に含められます:
既存の Vaults で、英国の EU 離脱の変更に伴い、管理者は以下の設定更新を行う必要があります:
- 英国の国レコードで、地域を欧州 (EU 非加盟国)に更新します。
- 欧州連合と呼ばれる地域のレコードを更新し、以下の国を追加します:
国名 | 地域 | 国コード |
英国 (北アイルランド) | EU | XI |
英国 (北アイルランドを除く) | 欧州 (EU 非加盟国) | XU |
- 新規に作成された国の関連するアプリケーション申請タイプ、サブミッション提出タイプ、サブミッション提出サブタイプ、および保健機関を含めるために制限レコードを追加します。
- UK、XI、および XU 国コードの製品タイプ管轄の制限レコードを更新または追加します。
- DTD XSD バージョンタイプとの制限レコードを追加し、英国固有の手続きタイプに対する制限を追加します。
- 既存のサブミッションコンテンツプランの EU モジュール 1 をコピーして、GB および XU の国コードにモジュール 1 を追加します。この推奨事項は、今後の MHRA のガイダンスによって変更される可能性があります。
レジストレーションの作成ウィザードは、今後のリリースで英国 (北アイルランド) を含むように更新されます。それまでは、ユーザはウィザードでこの値を手動で追加することができます。今後のリリースでは、医療機器用に、新しく英国政府承認期間の組織タイプが含めれられる予定です。
英国の EU 離脱に伴う 21R3 RIM の変更
21R3 (21R2.3) では、RIM Registrations Vaults の一括レジストレーション作成ウィザードでは、手続きタイプが中央管理手続きである場合に、自動的に英国 (北アイルランド) (国コード = XI)が含められる予定ですを含みます。21R3 までは、一般リリース Vault ユーザは、ウィザードにこの値を手動で入力することができます。